基因魔剪CRISPR-Cas由于其操作简单、靶向准确等特点,系统已成为世界主要实验中流行的基因编辑技术。12月23日凌晨,自然(Nature)来自非培养微生物的新研究在线发表CRISPR-Cas系统”(New CRISPR-Cas systems from uncultivated microbes),报告了两种新的CRISPR-Cas基因编辑系统:CRISPR–CasX 和CRISPR–CasY。吉利安是加州大学伯克利分校地质微生物学家·班菲尔德(Jillian F。Banfield)詹妮弗,分子生物学家·杜德纳(Jennifer Doudna)联合研究两个实验室。

加州大学伯克利分校的分子生物学家Jennifer Doudna是最早发现CRISPR-Cas9科学家之一。Credit:Cailey Conner,加州大学伯克利分校
詹妮弗·杜德纳是第一德纳CRISPR-Cas但是CRISPR-Cas专利所有权一直存在争议。值得注意的是,詹妮弗和其他人已经向美国专利和商标局提交了临时专利(provisional patent)申请。临时专利申请是在最终或完全申请完成前向专利局提交的临时或过渡性申请。本规定的目标主要是具有应用前景和潜在商业价值的结果,但不能申请专利。如果一项结果的应用前景不明确,可以先申请临时专利,然后再申请正式专利。

吉利安·班菲尔德(Jillian F。Banfield)在科罗拉多收集数据,CRISPR-CasX系统便发现于她采集到的细菌中,Roy Kaltschmidt 拍摄于2014年,来源:berkeley.edu
CRISPR–Cas系统的核心成员之一是Cas (即CRISPR associated protein),它是一种切割DNA酶是基因魔剪中的剪刀。
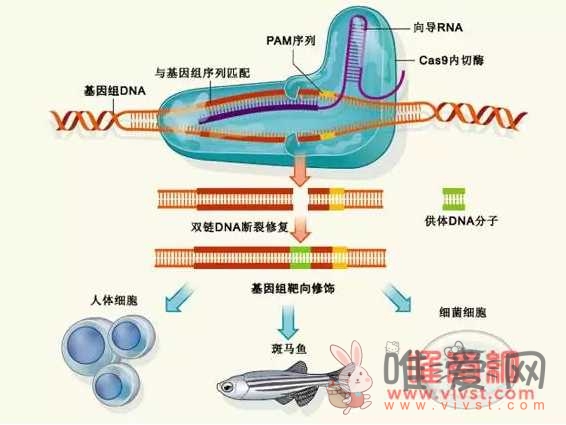
? RNA介导的CRISPR-Cas9系统定向基因组修饰机制示意图。Cas9一种内切酶DNA内切酶,许多细菌可以表达这种蛋白质,Cas9内切酶能为细菌提供防御机制,避免病毒或质粒等外源性DNA入侵Cas9内切 酶家族用于靶向和外源DNA的II型CRISPR/Cas免疫系统能有效地靶向酶切割。Cas9必须引导内切酶RNA在分子的指导下DNA进行切割,这是因为这些向导RNA 分子含有和靶DNA序列互补的序列称为PAM序列。Cas9向导内切酶RNA在特定位点的指导下,分子 DNA切割形成双链DNA在同源重组机制的帮助下,重组机制(homologous recombination)或非同源终端连接机制(non-homologous end joining)对断裂的DNA修复。如果细胞通过同源重组机制修复,则使用另一个 段DNA片段填充断裂DNA缺口将引入新的遗传信息,以实现基因编辑。图片选自上海南方模式生物研究中心。原始图片来源:
声明:本文内容采编自互联网,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请点击举报,一经查实,本站将立刻删除。